有机反应沿着不同的反应历程会得到不同的产物,如果反应还未达成平衡前就分离产物,利用各种产物生成速率差异来控制产物分布称动力学控制反应,其主要产物称动力学控制产物。
如果让反应体系达成平衡后再分离产物,利用各种产物热稳定性差异来控制产物分布称热力学控制反应或平衡控制反应,其主要产物称热力学控制产物。
两种控制的区别是在分离产物时反应体系是否达到平衡态,而此概念中并没有涉及反应条件, 反应条件不同只是通过影响在分离产物时反应体系离化学平衡态的距离而影响反应产物的分布。
要利用控制因素不同,而控制不同的主要产物,并不是任何平行反应都行,而是应当满足一定条件的反应才有可能。下面以A 分别生成B 和C 两种产物为例:
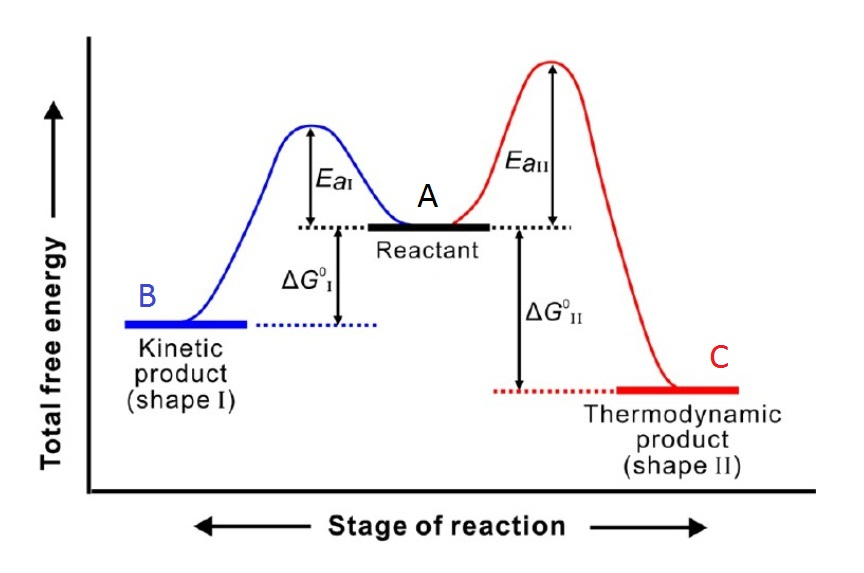
首先是两个方向均有明显的可逆性,
如果两个方向的反应几乎没有可逆性,B、C 一旦生成就不能逆转,直到反应物消耗完为止,很明显生成速度快者量最多,它就是主要产物,平衡也无从谈起,则产物都为动力学控制产物。
其二, 两种不同产物之间有较明显的热稳定性差异,
如上图所示,如C 的热稳定性明显比B高, 且热稳定性相对较好的C产物,生成反应有较高的活化能,当然它的生成反应速率较低,而热稳定性相对较低的B,生成反应却有较低的活化能,相应B有较高的生成反应速率。
【根据阿伦尼乌斯公式: k=Ae-Ea/RT (指数式)。k为速率常数,R为摩尔气体常量,T为热力学温度,Ea为表观活化能,A为指前因子(也称频率因子),活化能Ea越小,反应速率常数越大】
第三,有的反应还应当在一定的温度范围内进行。
同样根据阿伦尼乌斯公式: k=Ae-Ea/RT 。增加温度可以减小活化能的影响,因此,增加温度有利于得到热力学产物;降低温度,有利于得到动力学产物
在反应达到平衡前分离产物,无论什么温度范围内,始终有生成B产物的速率,大于生成C产物的速率,只是随着温度的升高两者的差异减小, 因此在任意温度下进行反应,在反应未达成平衡就分离产物时,反应受动力学控制— B 产物为主要产物。
若达成平衡后才分离产物,反应受热力控制— C产物为主要产物。在后一种情况下,两直线有一交点,设其对应温度为T,反应在低于T的温度范围内进行时,生成B的速率大于生成C产物的速率,仍然是反应受动力学控制时,B 产物为主要产物,而反应受热力学控制时,C 产物为主要产物。
当温度等于T 时,生成产物B 和C 的速率相等,所以反应体系离平衡尚远时产物中B、C 比例几乎相同,达成平衡后,C产物为主要产物。当温度高于T时,生成C产物的速率大于生成B产物的速率,C产物就既是热力学稳定产物,也是生成速率快的产物,无论是热力学控制产物,还是动力学控制产物,C产物均是主要产物。
从热力学方面:要使热力学稳定性较高的C产物在平衡产物中为主要产物,同样对温度有一定的限制,如果各种产物的平衡表达式形式相同,那么各种产物的平衡浓度与其平衡常数成正比例关系。
在有机化学中,绝大多数反应是动力学控制的。也有很多涉及动力学和热力学控制竞争的例子。例如羟醛缩合反应用NaOH这种弱碱会生成更稳定的化合物。主要产物为热力学更稳定的产物,动力学控制的反应通常设计低温,强(路易斯)酸强(路易斯)碱的条件,LDA拔氢条件下,会拔掉位阻最小(动力学上最容易接近)的氢生成烯醇负离子中间体,然后进攻另一个羰基,得到的反应结果很可能与NaOH条件下的不同;1,3-丁二烯与氯化氢的加成反应,1,2-加成产物为动力学控制产物,1,4-加成产物为热力学控制产物;甲苯的磺化反应,邻对位取代的比例控制;萘的磺化反应,α,β异构体的比例控制。
1. 热力学产物与动力学产物是同一种的反应
1-1. Ag+与I-的反应
Ag+氧化能力与Fe3+相近(φ(Ag+/Ag)=0.7995 V,φ(Fe3+/ Fe2+)=0.771 V),Fe3+能够氧化I-(2Fe3++2I-=2Fe2++I2),而Ag+与I-并不发生氧化还原反应,而是生成AgI沉淀。
分别考虑如下两个竞争反应:
Ag++I-=AgI 反应1
2Ag++2I-=2Ag+I2 反应2
从热力学角度考虑,经计算,两个反应的平衡常数分别为:K1=1.2*1016,K2=2.9*108。从动力学角度考虑,反应1的活化能较低,反应更快。综上,AgI既是动力学产物,又是热力学产物,所以最终生成沉淀而非发生氧还。
那么问题来了,能否通过“改造”反应装置使得反应2的产物占主导呢?我们可以强行隔断Ag+与I-的接触,只让两者之间发生电子的转移即可,也就是将其改造成双液原电池装置,即可发生反应2而避免反应1的发生。
一些类似的反应:Cu2+、Ag+、Hg2+与S2-的反应。Fe3+与S2-的反应比较复杂,在此不做展开。
2. 热力学产物与动力学产物竞争的反应
2-1. Cl2水与石蕊
将石蕊滴入新制氯水中,观察到的现象为溶液先变红后褪色,变红是因为石蕊结合溶液中的H+,褪色是因为石蕊被HClO氧化,前者为动力学控制,后者为热力学控制。
一些类似的反应:Na2O2与水反应后加入酚酞。
2-2. Na与CuSO4的反应
从氧化性顺序上来看,Na更倾向于还原Cu2+而非水中的H+,但是由于Cu2+是以水合离子的形式存在,Na接触Cu2+之前必然会接触H2O,从而将电子转移至H+产生H2,H2在这种情况下难以将其获得的电子重新传递至Cu2+(活化能太大,类似的例子比如制备氢氧燃料电池时,电极材料需要使用Pt有效降低H2给电子的活化能才可以),从而实现了该反应最终产生动力学产物H2而非热力学产物Cu。但是值得说明的是,假如条件合适,H2能够把Cu2+还原为Cu,例如2022年山东卷第12题,就采用了高压H2来还原溶液中的Cu2+。
2-3. 1,2加成与1,4加成
见2020年山东卷第14题。
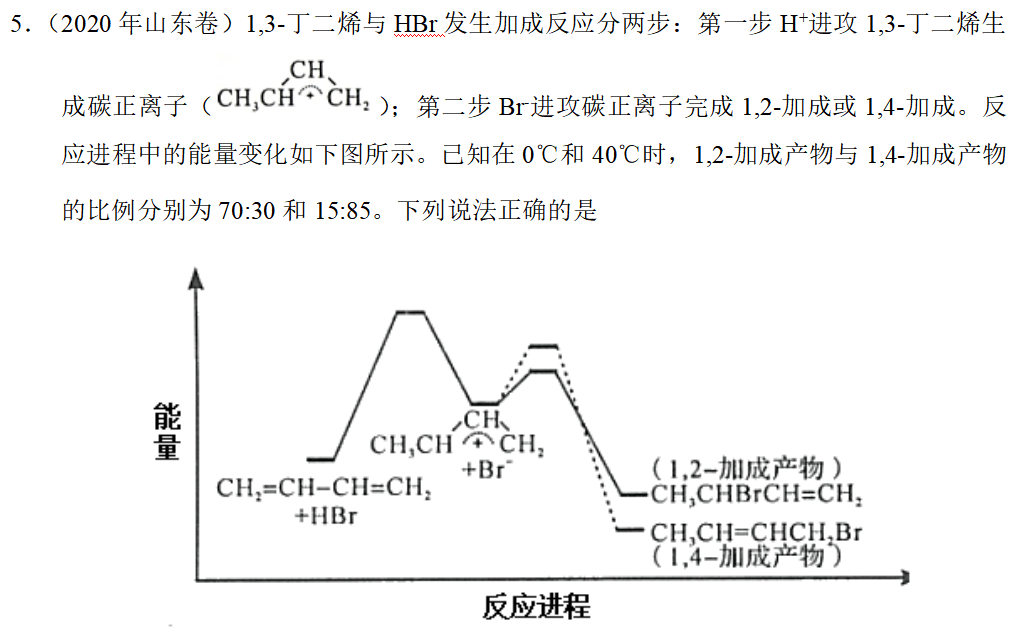
5.答案:AD
补充思考:两个历程第一步相同,生成1,4-加成产物的历程中第二步活化能大于生成1,2-加成产物的历程中第二步活化能,因此升高温度时,生成1,4-加成产物的反应速率提高程度更大,1,4-加成产物的比例提高。
6.答案:AB
当我们讨论有机反应中的产物选择性时,我们常常将热力学产物与动力学产物对立起来,共轭二烯烃的1,2-加成与1,4-加成的选择性问题就是这样的典例:
我们一般称前一个1,4-加成产物为热力学产物,而后者为动力学产物,这是由于1,4加成产物烯烃取代度更高,产物更加稳定,但机理中多了一步双键的位移。升温对1,4-加成产物有利,且若经过足够长时间,1,2-加成产物可以较多转化为1,4-加成产物。
有机当中的热力学产物与动力学产物竞争的例子还是比较多的,例如萘的磺化、DA反应等。
2-5. HgI2的异构化反应
笔者并没有做这个实验,但是先将文献翻译在此。据文献说法,这个实验很适合课堂演示,现象明显且时长也合适,具体需要实验验证后方可给出结论。
溶液A1:3.06 g HgCl2溶于225 mL水中;
溶液A2:溶液A1稀释8倍(0.0063 mol/L);
溶液 B1:3.74 g KI溶于225 mL水中;
溶液B2:溶液B1稀释8倍(0.0071 mol/L)
保持磁力搅拌,将B1加入A1中:迅速变为亮橙色,后续变化不明。
保持磁力搅拌,将B2加入A2中:迅速变为柠檬黄(动力学产物),保持搅拌,大约45min变为橙红色(热力学产物)。
2-6. 氨的氧化
考虑如下两个反应:
4NH3+3O2=2N2+6H2O 反应3
4NH3+5O2=4NO+6H2O 反应4
分别计算两者的平衡常数(为了方便起见,均选择500 K):K3=7.1*1026,K4=11.1*1034,N2为热力学产物。在实际生产HNO3过程中,我们更希望NH3发生反应4而不是反应3,因此,我们通常需要使用特定催化剂,增大反应4的反应速率,以获得动力学产物。
阅读 2135
评论详情