☆化工流程型陌生化学方程式的书写
化工流程中的陌生化学(离子)方程式的书写。信息“新”、内容别致、陌生度高的信息型化学方程式的书写。首先通过准确、有效接受、吸收试题中的流程、图表等新信息,并将信息与课本知识有机地结合起来,达到以旧带新、触类旁通的作用,进而产生新思路,发现新规律,创造性地解决问题(包括氧化还原反应型和非氧化还原反应型方程式的书写)。
【例1】铈是一种重要的稀土金属元素,以下是其重要化合物Ce(OH)4的一种制备流工艺程图:
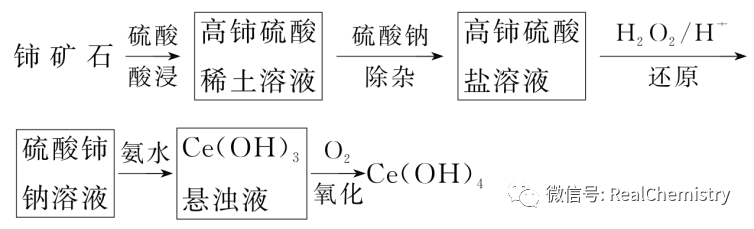
(注:高铈是指溶液中Ce为+4价)
①写出加入氨水时发生反应的离子方程式___________________________________。
②“氧化”过程若用NaClO代替O2,写出该反应的离子方程式_________________________________。
(2)将NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,试写出该反应的离子方程式为_____________________________________________________________。
在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+。试写出用ClO2氧化除去Mn2+生成MnO2的离子方程式为______________________________________(ClO2反应后的产物为ClO2-)。
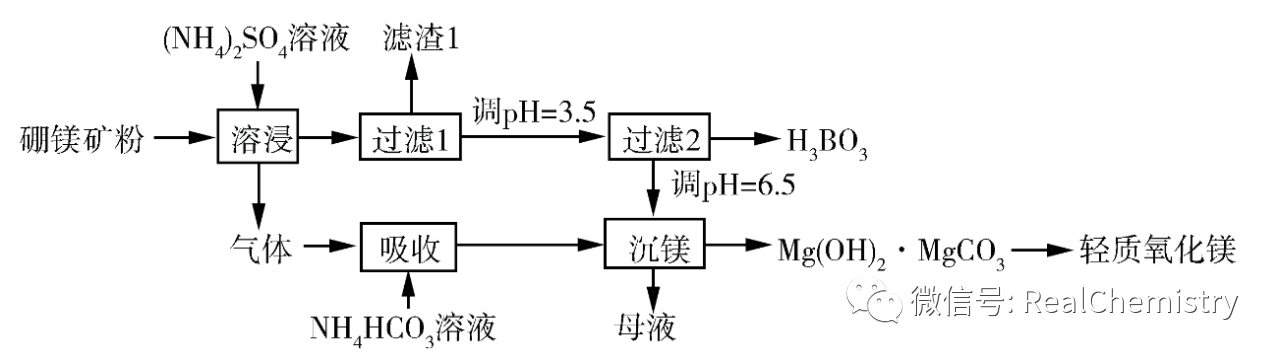
【例2】 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生气体在“吸收”中反应的化学方程式为_________。
(2)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为______ ____。
【答案】
(1). NH3+NH4HCO3=(NH4)2CO3
(2). 2Mg2++2H2O+3CO32-=Mg(OH)2∙MgCO3↓+2HCO3-
(或2Mg2++H2O+2CO32-=Mg(OH)2∙MgCO3↓+CO2↑)
【解析】
(1)根据流程图知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收,反应方程式为:NH3+NH4HCO3=(NH4)2CO3;
(2)沉镁过程中用碳酸铵溶液与Mg2+反应生成Mg(OH)2∙MgCO3,沉镁过程的离子反应为:2Mg2++2H2O+3CO32-=Mg(OH)2∙MgCO3↓+2HCO3-。
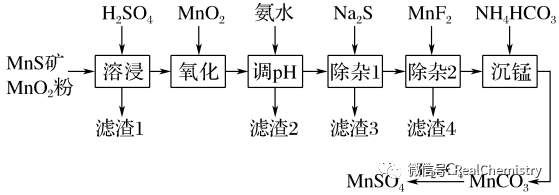
【例3】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
|---|---|---|---|---|---|---|---|
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“滤渣1”含有S和________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式:
___ _______。
⑵写出“沉锰”的离子方程式___________________________________________________。
【答案】
(1)SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4===2MnSO4+S+2H2O
(2)Mn2++2HCO3-===MnCO3↓+CO2↑+H2O
【解析】
(1)硫化锰矿中硅元素主要以SiO2或不溶性硅酸盐形式存在,则“滤渣1”的主要成分为S和SiO2(或不溶性硅酸盐)。结合“滤渣1”中含S,可知“溶浸”时MnO2与MnS在酸性条件下发生氧化还原反应生成MnSO4和S,根据得失电子守恒可配平该反应。(2)“沉锰”即向MnF2溶液中加入NH4HCO3生成MnCO3
☆信息型陌生化学反应方程式的书写
“信息型”化学(离子)反应方程式书写一类试题是历年高考的高频考题。该类题的特点是:信息新颖,新旧相承,知识引路,培养能力,它能较好地考查学生接受、提取、处理新信息的能力以及根据新信息结合已有知识分析问题和解决问题的应变能力(包括氧化还原反应型和非氧化还原反应型方程式的书写)。信息型化学方程式书写题的基本解题思路是:
【例1】高铁酸钾(K2FeO4)是一种易溶于水,高效的多功能水处理剂。工业上通常先制得高铁酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从而使高铁酸钾析出。
(1)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。该反应的离子方程式为__________________。
(2)在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:___________________________________________________________________。
答案(1)4FeO42-+10H2O===4Fe(OH)3(胶体)+8OH-+3O2↑
(2) 2Fe3++3Cl2+16OH-===2FeO42-+6Cl-+8H2O
【例2】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和,其离子方程式为。
陌生非氧化还原反应方程式的书写
知识梳理
运用“证据→推理→符号”思路书写新情况方程式的基本过程如下:“读”取题目中的有效信息(证据),写出反应物和生成物的符号(推理+表征),再依据质量守恒、电荷守恒(基本规律),即可轻松写出规范的方程式。
例Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式:______________。
答案FeTiO3+ 4H++ 4Cl-===Fe2++TiOCl42-+2H2O
针对性训练
题组一 根据“广义”的水解书写方程式
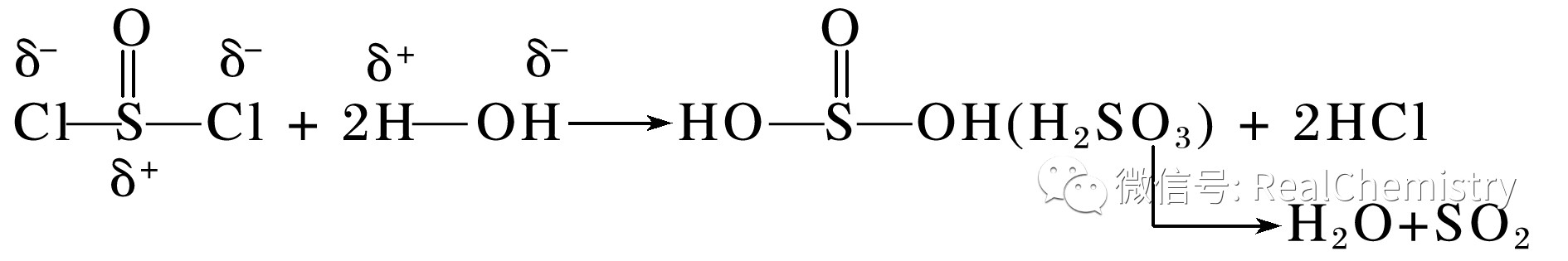
1.写出亚硫酰氯(SOCl2)在潮湿的空气中产生白雾的化学方程式:_______________
答案SOCl2+H2O===SO2↑+2HCl↑
解析
2.一氯胺(NH2Cl)是一种重要的水消毒剂,写出产生消毒物质的化学方程式:___________
答案NH2Cl+H2O===NH3+HClO
3.四氯化硅与烧碱溶液反应生成两种盐的化学方程式:__________________________________。
答案SiCl4+6NaOH===Na2SiO3+4NaCl+3H2O
4.常用尿素[CO(NH2)2]除去工业废水中Cr3+,流程为:
含,完成该转化的离子方程式:___________________________。
答案2Cr3++3CO(NH2)2+9H2O===2Cr(OH)3↓+3CO2↑+6NH4+
题组二 根据“中和”原理或“强酸制弱酸”原理书写
5.根据要求完成下列化学方程式:
(1)25 ℃,H2C2O4和HF两种酸的电离平衡常数如下:
| H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
|---|---|---|
| HF | Ka=6.31×10-4 | |
则H2C2O4溶液和NaF溶液反应的离子方程式为_______________________________
(2)多硼酸盐四硼酸钠(Na2B4O7)与硫酸反应可制硼酸(H3BO3),写出反应的化学方程式:________________________________________________________________________
答案(1)H2C2O4+F-===HF+HC2O4-
(2)Na2B4O7+H2SO4+5H2O===Na2SO4+4H3BO3
6.少量CO2分别通入①NaClO溶液、②漂白粉溶液的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________。
答案①NaClO+CO2+H2O===NaHCO3+HClO
②Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
7.工业上可用盐酸处理铝硅酸盐,如正长石(KAlSi3O8)制取硅酸胶体。写出该反应的化学方程式:________________________________________________________________________
答案KAlSi3O8+4HCl+H2O===KCl+AlCl3+3H2SiO3(胶体)
题组三 应用“平衡转化”思想书写
8.沉钴工艺流程如下图所示,请写出“沉钴”过程中的离子方程式:____________________。
[解题思路]该反应的微观平衡移动过程如下:
答案Co2++2HCO3-===CoCO3↓+CO2↑+H2O
9.利用制磷肥的副产物氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下:
(1)分解过程发生的反应为Na2SiF6+4NH3·H2O===2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为________。
(2)水浴加热过程中生成冰晶石的化学方程式为__________________________________。
答案(1)SiO2(2)2NaF+4NH4F+NaAlO2水浴加热======Na3AlF6↓+4NH3↑+2H2O
题组四 根据对热稳定性的理解书写
10.Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800 ℃的氩气中烧结6小时制得Li2FeSiO4。写出该反应的化学方程式:___________________________________________________________________________。
答案Li2CO3+FeC2O4·2H2O+SiO2高温=====Li2FeSiO4+CO↑+2CO2↑+2H2O↑
11.“煅烧”偏钒酸铵(NH4VO3)可得到工业制硫酸的催化剂五氧化二钒(V2O5),写出该反应的化学方程式:_____________________________________________________________________________。
答案2NH4VO3△=====V2O5+2NH3↑+H2O↑
12.双氧水、84消毒液是日常生活中常用的消毒剂。
(1)84消毒液(主要成分是NaClO)溶液呈碱性,用离子方程式表示其原因:________
________________________________________________________________________。
(2)双氧水和84消毒液混合失去消毒作用,生成无色无味气体,该气体为________(填化学式)。
(3)工业上,制备84消毒液的原理是:以惰性电极电解饱和氯化钠溶液,产生的氯气用生成的烧碱溶液吸收。阴极发生的电极反应式为__________________________;写出制备84消毒液的总反应化学方程式:_____________________________________________________。
(4)双氧水是二元弱酸,298 K时,Ka1=1.6×10-12,Ka2=1.0×10-25,双氧水电离的方程式为__________________;298 K时0.1 mol·L-1双氧水溶液的pH≈__________。(已知:lg 2≈0.3)
答案(1)ClO-+H2OHClO+OH-(2)O2
(3)2H2O+2e-===2OH-+H2↑NaCl+H2O电解=====NaClO+H2↑
(4)H2O2H++HO2-、HO2-
H++O22-6.4
13.氮氧化合物是大气污染的重要因素,将NOx转化为无害物质是当前研究的重要课题。
(1)将NO2在适当的反应条件下变成无害的N2,必须要找到适合的物质G,G应为________(填“氧化剂”或“还原剂”)。
(2)下式中X必须为无污染的物质,系数n可以为0。
NO2+G催化剂――→N2+H2O+nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是____________(填字母)。
a.NH3b.CO2c.SO2d.CH3CH2OH
(3)若G为天然气的主要成分,则X为______________,n=__________。
答案 (1)还原剂 (2)ad(3)CO21
14.硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
(1)用离子方程式表示Na2S溶液呈碱性的原因:________________________________
________________________________________________________________________。
(2)空气中久置的硫化钠溶液会产生浅黄色沉淀,写出反应的离子方程式:
________________________________________________________________________
(3)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,产生黄色沉淀,写出化学方程式,并标出电子转移的方向和数目:_____________________________________________。
(4)CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理和离子方程式进行解释:_______________________________________
答案(1)S2-+H2OHS-+OH-(2)2S2-+O2+2H2O===2S↓+4OH-
(3)3H2O(4)在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,FeS(s)+Cu2+(aq)===CuS(s)+Fe2+(aq)
1.月球是个丰富的矿产宝库,地球上已经探明的元素在月球上基本都能找得到。
(1)MgCl2在工业上应用广泛,可由MgO制备。
①某月壤样品经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为________________________________________________________________________。
②MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为____________________________________(写化学式)。
(2)取少量铝粉和Fe3O4反应后所得的固体混合物,将其溶于足量稀硫酸,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe3O4,理由是____________________________(用离子方程式说明)。
答案(1)①SiO2+2OH-===SiO32-+H2O②NaCl、NaClO、Na2CO3
(2)不能 Fe3O4+8H+===2Fe3++Fe2++4H2O、2Fe3++Fe===3Fe2+
15.元素铬(Cr)的化合物有多种,其转化关系如下,
回答下列问题:
(1)交警检测醉驾的原理之一:乙醇在稀硫酸中被CrO3氧化为CO2,发生了①的转化。请写出该检测醉驾原理的化学方程式:__________________________________________
(2)转化②所用的试剂是硫酸酸化的H2O2,写出转化②的离子方程式。[已知Cr2(SO4)3是可溶于水的强电解质]___________________________________。
(3)在硫酸酸化的条件下可实现③的转化,写出转化的离子方程式:_____________________。
答案(1)4CrO3+C2H5OH+6H2SO4===2Cr2(SO4)3+2CO2↑+9H2O
(2)Cr2O72-+3H2O2+8H+===2Cr3++3O2↑+7H2O
(3)2CrO42-+2H+===Cr2O72-+H2O
16.利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、SO42-等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
(1)TiO2+中钛元素的化合价为________价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式:_________________________________
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释:________________________________________________________________________。
(3)NH4HCO3溶液与FeSO4溶液反应的离子方程式为______________________________,
该反应需温度在308 K以下,其目的是_____________________________________
答案(1)+4TiO2++(n+1)H2OTiO2·nH2O+2H+
(2)Na2CO3消耗H+,c(H+)减少,使TiO2+水解平衡向生成TiO2·nH2O方向移动
(3)Fe2++2HCO3-===FeCO3↓+CO2↑+H2O
防止NH4HCO3受热分解和减少Fe2+的水解
17.常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
(1)沸腾氯化炉中发生的主要反应为_________________________________________
(2)TiCl4遇水强烈水解,写出其水解的化学方程式:___________________________
答案(1)TiO2+2C+2Cl2900 ℃=====TiCl4+2CO
(2)TiCl4+4H2O===Ti(OH)4↓+4HCl↑
18.(2017·河南模拟)铜及其化合物在工业上有广泛的用途,回答下列问题:
(1)制备生氢剂CuH,完成下列反应方程式:________H3PO2+________CuSO4+________H2O===________CuH+________H3PO4+________H2SO4,生成的CuH易在氯气中燃烧,则完全燃烧的产物是______________。
(2)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用,某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如图1:
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是_______________________________。
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式:_______________
________________________________________________________________________。
③写出“沉锰”反应时的离子方程式:______________________________________。
(3)纳米Cu2O是一种新型光电材料,利用如图2所示的装置可制得,则工作中阳极上的电极反应式为________________________________________________________________________
________________________________________________________________________。
答案(1)346434CuCl2、HCl
(2)①提高浸取率 ②2MnO2+Cu2S+4H2SO4===S↓+2CuSO4+2MnSO4+4H2O③Mn2++NH3+HCO3-===MnCO3↓+NH4+(3)2Cu+2OH--2e-===Cu2O+H2O
评论详情