有许多高考模拟题在物质结构选考题中设问,铁原子核外能量最高的电子处于什么能级,答案有说是3d,也有说是4s。可以说观点不一,仁者见仁智者见智,莫衷一是。
但是高考题会指挥中学化学教学。
铁原子形成离子时一定是先失去4s的电子,而不是3d的电子!这一点要非常明确,不能模棱两可。这个可以在大学化学教材上得到证实,而且2019年高考题明确考了,我们老师备考时一定要注意这点。
2019年高考全国2卷35.
[化学——选修3:物质结构与性质]
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
答案:(2)4s 4f5
金属原子首先失去最外层电子,所以Fe先失去4s电子,一定要得出4s比3d电子容易失去的结论。
另外进行类比,Sm的价层电子排布式为4f66s2,先失去外层的6s电子,再失去一个4f电子,所以为4f5。
我们都知道电子填充时,一般是认为3d比4s能量高,先填充4s,后填充3d。这是依据鲍林的能级图。鲍林的能级图只是个近似的能级图,是帮助我们理解电子的填充过程。
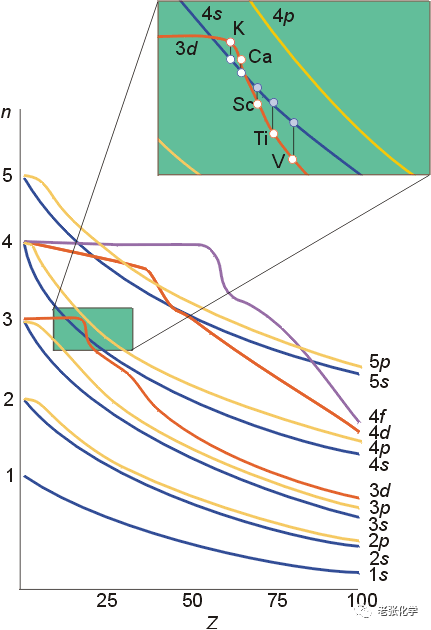
但电子填充后轨道能级会发生改变,电子的失去过程必须用科顿原子轨道能级图来解释。
鲍林近似能级图是在没有考虑外层电子对内层电子影响下提出的,而科顿原子轨道能级图考虑了外层电子对内层电子的挤压效应。
举个简单的例子,一座大楼,随着大楼变高,一楼承受的压力越大,这样就会使一楼逐渐被“压扁”(当然,这个效应很弱,否则谁还敢住一楼),原子也是这样,随着核电荷数的升高内层电子就会逐渐趋于稳定,这使得内层电子能量逐渐降低。
科顿原子轨道能级图正是反映了这种效应,只不过由于3d和4s在核电荷数升高时能量降低幅度不一样,造成了这种暂时性的能级交错。
事实上,这种效应(3d>4s)只维持到了25号元素,后面的元素都是4s>3d的,事实上,随着原子序数的增加,4s和3d都趋于稳定,只不过3d能量降得比较快(受挤压效应影响大)而已。
其实电子排布不但有能量最低原理,还有泡里不相容原理,洪特规则等等,是一个相互影响相互协调的过程。
当3d轨道没有电子填充时,3d轨道的能量大于4s轨道能量(例如Na原子和 Ca原子);当3d轨道上已填充上电子时,4s轨道的能量大于3d轨道的能量(例如Ti原子和V原子)。因为3d轨道上填充有电子时,由于它对 4s电子产生屏蔽作用,使4s轨道电子能量升高的结果.
所谓的能级交错,是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。由于屏蔽效应和钻穿效应,使不同轨道上的电子能级发生变化,从而引起能级上的交错。
如4s反而比3d的能量小,填充电子时应先充满4s而后才填入3d轨道。过渡元素钪的外层电子排布为4s23d1,失去电子时,按能级交错应先失去3d电子,成为4s23d0,而从原子光谱实验得知,却是先失4s上的电子成为4s13d1。这是由于3d电子的存在,削弱了原子核对4s电子的吸引而易失去的。
过渡元素离子化时,大体是先失去ns电子,但也有先失去(n-1)d电子的,像钇等。能级交错的顺序不是绝对不变的,在原子序数大的原子中,3d轨道可能比4s轨道的能量低。
可以认为:填充时考虑能级交错,失电子时考虑先外后内。在3d、4s都没有电子的时候,能量是3d高于4s,当形成原子以后,填充了电子,力场发生变化,不再能级交错,就是4s高于3d。
Fe失去电子形成Fe2+时,失去4s还是3d轨道上电子?
第一种理解:根据原子轨道能量高低判断,轨道中填充电子时,4s轨道能量高于3d轨道,优先失去能量更高的4s电子,Fe的价电子排布式为3d64s2,所以在失去电子时首先失去4s电子,因此Fe2+的价电子组态为3d6
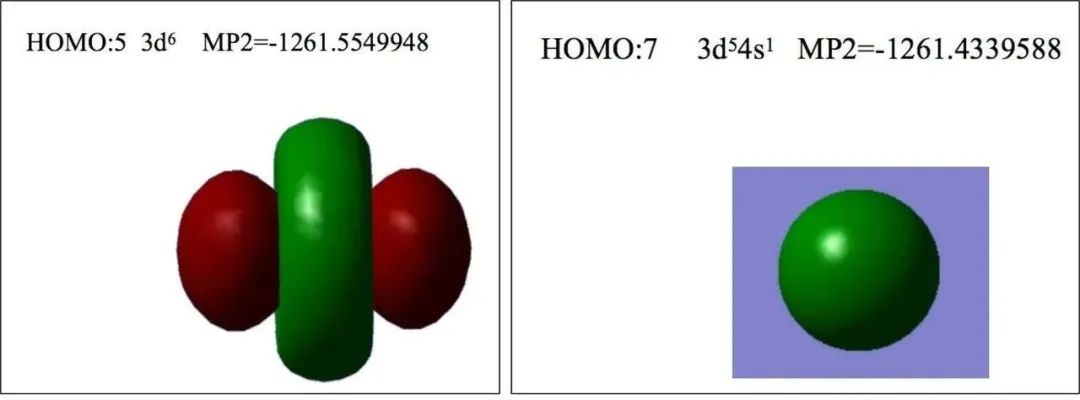
第二种理解:根据原子失电子后形成离子的能量高低进行判断,能量更低的情况将是离子的电子排布。对比Fe2+与Cr的价电子排布,为什么Fe2+不是3d54s1?软件计算结果表明Fe2+以3d6价电子组态存在能量更低
基于排斥能、轨道能量差角度解释Fe2+的价电子组态是3d6
基于电子间的排斥能和轨道间的能量差进行综合分析。3d54s1避免了3d轨道成对电子的排斥能,但是引入了4s与3d轨道间的能量差;反之,3d6避免了电子进入4s轨道的能量升高,却引入了3d轨道成对电子的排斥能。所以,何种电子组态能量更低,取决于该体系的3d同轨道里电子的排斥能与4s/3d轨道能量差之间的相对大小。不同元素的原子4s/3d轨道能量差存在差异,如图-3所示,Cr的4s/3d轨道能量差较小,Cr的价电子以3d54s1电子组态存在,高能量的4s轨道填入1个电子避免了3d轨道电子间斥力使体系能量较低,此时3d轨道电子半排满,3d简并轨道中自旋相同的单电子最多,电子间交换能更大从而使体系能量更低。Fe的4s/3d轨道能量差较大,对于Fe2+,由于4s轨道能量明显高于3d轨道,离子的价电子不填入4s轨道则体系的能量更低,离子更稳定,此时3d轨道填入6个电子,存在电子间的斥力使体系能量升高,但如果4s轨道填入1个电子则体系能量升高更明显,所以Fe2+以3d6电子排布存在。
评论详情