几乎所有化学的初学者都喜欢看把碱金属扔进水中的“实验”。在中学阶段,大多数学生最多只能接触到钠和钾与水反应的现象(毕竟是高考考点)。当小块钠进入水中时,主要的现象只有钠块熔化和滋滋作响地放出氢气(我知道还有其他的三条,但是这里不做展开介绍了);当小块的钾被投入水中,则会燃烧起来同时在反应后期发生小规模的爆炸(事实上大块的钠与水反应也可能引发爆炸)。更加活泼的铷和铯则会在接触到水的瞬间就剧烈爆炸。
然而,这个看上去十分简单粗暴的反应背后的机理却并不简单。高中对于“爆炸”这一现象最常见的解释是:碱金属与水反应放出的热量引爆了氢气。这种观点大体上没有问题,但不要忘了碱金属与水的反应应该是一个表面反应,也就是其速率受到碱金属与水接触面的限制,因此似乎不应该反应得这么快。
事实上,碱金属有一个非常简单粗暴的特性,就是它们都极其容易把自己的唯一一个电子扔出去。在极性溶液中,它们把电子扔出去的方式则更加简单粗暴:
像盐那样电离成碱金属离子和电子。在水的作用下,碱金属会迅速形成水合碱金属离子和溶剂合电子,这一步可以称为碱金属的溶剂化。这种在极性溶剂中电离的情况并不少见。以钠为例,将金属钠投入液态的氨中,会得到一种深蓝色的溶液: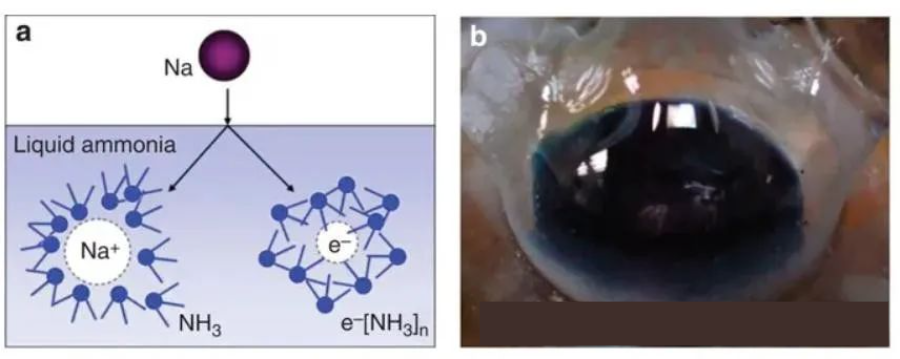 钠在液氨溶液中电离(左)的示意图和钠的液氨溶液(右)。[1]
钠在液氨溶液中电离(左)的示意图和钠的液氨溶液(右)。[1]
这种溶液的分解并不像钠和水的反应一样迅速:它缓慢地分解为氢气和氨基钠(NaNH2)。溶液的深蓝色来自于电子在溶剂氨分子形成的空腔内的运动,这是溶剂合电子的特征颜色。回到碱金属与水的反应上来,如果我们用高速摄影机记录碱金属与水的反应,也会看到类似的蓝色: 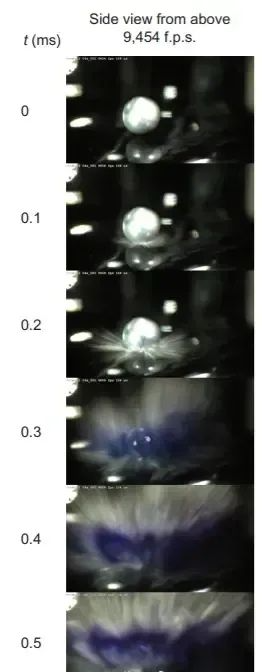 高速摄影机拍摄的钠钾合金与水的反应[2]。可以看到,在碱金属与水反应的过程中,熟悉的深蓝色同样出现了。这与之前碱金属和氨的反应是类似的,只是在这个过程中,不稳定的水合电子代替了氨合电子。它的稳定性比氨合电子要差得多,在生成之后(大概几毫秒内)就迅速分解为氢氧根和氢气,不借助高速摄影机很难捕捉到这种不稳定的蓝色。碱金属进入水中之后,表面的一层电子会迅速被周围的水分子俘获,使得碱金属表面产生一层带正电的碱金属阳离子。这种碱金属阳离子之间存在巨大的静电斥力,因此引发“库仑爆炸”(Coulomb explosion)[2]。在排斥的过程中,静电斥力会在碱金属的表面拉出诸多刺状结构,增大碱金属与水接触的表面积,进一步引发碱金属与水的反应。这使得碱金属与水的反应远远比一般的两相反应来得快,从而最终在短时间内产生大量氢气,同时释放热量。
高速摄影机拍摄的钠钾合金与水的反应[2]。可以看到,在碱金属与水反应的过程中,熟悉的深蓝色同样出现了。这与之前碱金属和氨的反应是类似的,只是在这个过程中,不稳定的水合电子代替了氨合电子。它的稳定性比氨合电子要差得多,在生成之后(大概几毫秒内)就迅速分解为氢氧根和氢气,不借助高速摄影机很难捕捉到这种不稳定的蓝色。碱金属进入水中之后,表面的一层电子会迅速被周围的水分子俘获,使得碱金属表面产生一层带正电的碱金属阳离子。这种碱金属阳离子之间存在巨大的静电斥力,因此引发“库仑爆炸”(Coulomb explosion)[2]。在排斥的过程中,静电斥力会在碱金属的表面拉出诸多刺状结构,增大碱金属与水接触的表面积,进一步引发碱金属与水的反应。这使得碱金属与水的反应远远比一般的两相反应来得快,从而最终在短时间内产生大量氢气,同时释放热量。  钠钾合金与水的反应,可以看到大量“金属刺”的出现[2]。
钠钾合金与水的反应,可以看到大量“金属刺”的出现[2]。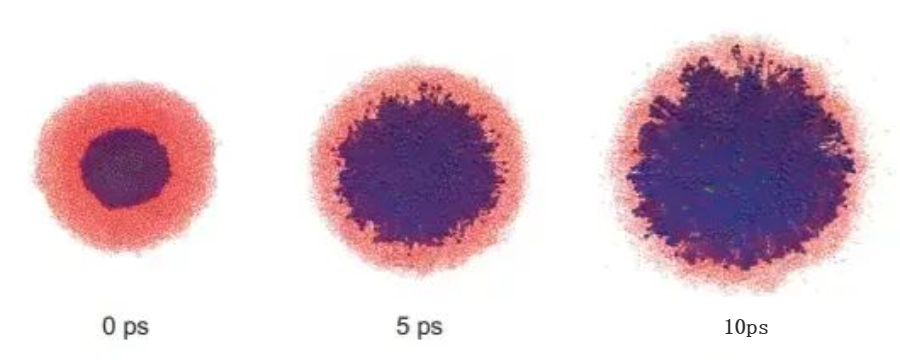 分子动力学对钠簇在水中反应的模拟结果。当碱金属表面的正电荷(蓝色小球)与负电荷(红色小球)之间的平均距离大于5×10^-10m时,库仑爆炸就会迅速发生。[2]在液面局部区域,氢气的浓度是相当大的。如果碱金属足够活泼(电离得更快)或量够大,那么这个过程中释放出的热量足以混合氢气和氧气并将它们点燃,引发“真正的”爆炸现象。之前我们提到了碱金属与液氨的反应。那么,为什么碱金属和液氨的反应不会发生爆炸呢?事实上,碱金属和液氨的反应过程中同样存在库仑爆炸现象,“金属刺”同样会生成。不同的是,液氨合电子的稳定性要远远好于水合电子。这与氨分子及水分子的电子结构关系密切:由于氧具有更大的电负性,在水分子中,氢上带有更多的正电荷,因此比氨分子更容易俘获电子。因此,尽管碱金属与氨的反应同样迅速,这一过程并不会产生大量的氢气,因此也不会发生爆炸。
分子动力学对钠簇在水中反应的模拟结果。当碱金属表面的正电荷(蓝色小球)与负电荷(红色小球)之间的平均距离大于5×10^-10m时,库仑爆炸就会迅速发生。[2]在液面局部区域,氢气的浓度是相当大的。如果碱金属足够活泼(电离得更快)或量够大,那么这个过程中释放出的热量足以混合氢气和氧气并将它们点燃,引发“真正的”爆炸现象。之前我们提到了碱金属与液氨的反应。那么,为什么碱金属和液氨的反应不会发生爆炸呢?事实上,碱金属和液氨的反应过程中同样存在库仑爆炸现象,“金属刺”同样会生成。不同的是,液氨合电子的稳定性要远远好于水合电子。这与氨分子及水分子的电子结构关系密切:由于氧具有更大的电负性,在水分子中,氢上带有更多的正电荷,因此比氨分子更容易俘获电子。因此,尽管碱金属与氨的反应同样迅速,这一过程并不会产生大量的氢气,因此也不会发生爆炸。
评论详情